在去年12月CFDA颁布《细胞治疗用产品的研究与评价技术指导原则》之后,今年的3月13日CDE公布了《细胞治疗产品申请临床试验药学研究和申报资料的考虑要点》(以下简称《要点》),关于细胞治疗出台的政策之快可以看出新型的细胞产业得到了政府的极大重视。

相对于传统的药物而言,CAR-T细胞治疗技术回输进入人体的是活细胞,其在研发、制备、临床应用及其安全性评估方面都和以往的药物有着极大的不同。这对于从事CAR-T研发的公司来说是一个挑战,对于政策和审批同样是一个巨大的挑战——制定完善的审批制度和有力的监管才能保证CAR-T治疗技术更好的为临床患者服务。
相对于国外已经有CAR-T治疗产品上市,国内目前CAR-T尚在布局阶段,竞争要远大于国外。估计未来国内CAR-T市场会达到千亿的量级,而单单是血液肿瘤,我国每年新增市场总计就接近185亿元。
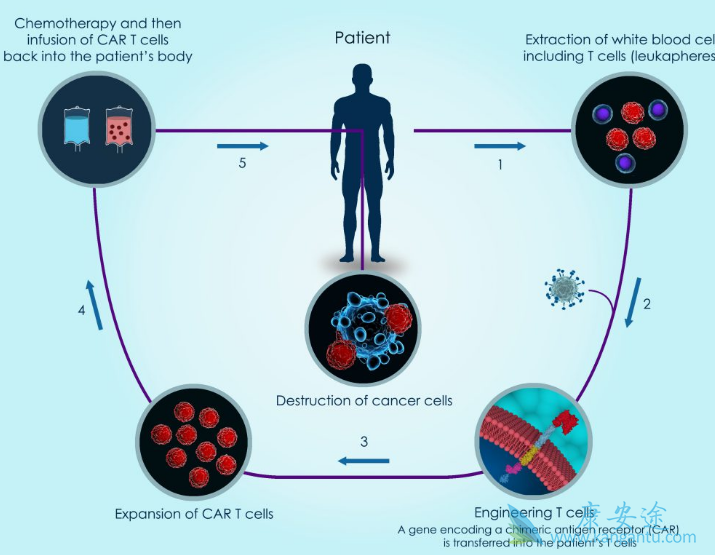
此外,国内有超过40家公司布局CAR-T治疗领域,相信在接下来的一年里,我们会看到更多的CAR-T产品申报和获批进入临床,为患者提供更佳的肿瘤治疗。
















请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)