在扩展阶段,根据MET失调性而招募了包括原始NSCLC扩展组在内的实体瘤患者。最初的扩展组招募了以600 mg bid胶囊剂量局部或集中评估MET失调(包括MET减少和扩增)的患者。通过中央组织以400 mg片剂的剂量确定的免疫组化(MET IHC 3+)方法,将另一组患者纳入高MET状态的EGFRwt NSCLC患者。通过对基因组畸变的事后分析[MET基因拷贝数(GCN)的获得和FISH和MET的扩增]进一步完善了按MET状态进行的患者选择标准下一代测序(NGS)进行突变],其中有足够的肿瘤样本。该研究的主要目的是在剂量递增部分中完成的,目的是确定单药口服卡马替尼(INC280)的最大耐受剂量(MTD)/ RP2D [基于发生率,发生频率和剂量类别-限制毒性和不良事件(AE)。关键的次要终点是每个RECIST的总体缓解率(ORR)。此处报道的该研究的第二部分的主要次要目的是探讨卡马替尼在MET依赖性NSCLC患者中的抗肿瘤活性。
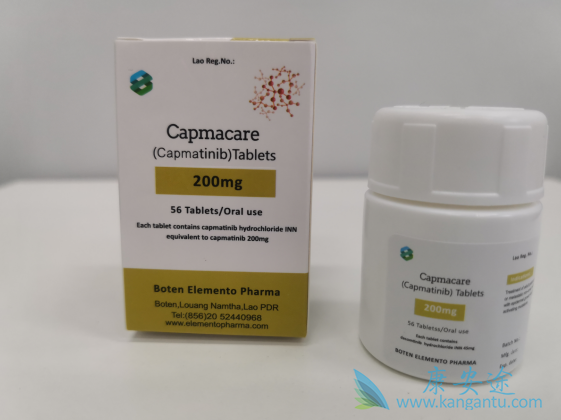
这项研究招募了成年患者(≥18岁),其对目前可用的疗法难以治疗或没有有效治疗的晚期NSCLC。原始NSCLC剂量扩大组中的分子生物标志物状态标准为MET H评分≥150或MET/着丝粒比率≥2.0或METGCN≥5或≥50%IHC评分为2+或3+的肿瘤细胞本地或中央。在另外的NSCLC扩展组中,分子生物标志物状态标准是MET IHC 3+在≥50%集中确定的肿瘤细胞中表达并记录在案的EGFRwt状态。
通过总抗c-MET(SP44)兔单克隆抗体确定MET表达水平。进行回顾性中央分析,以确定所有有肿瘤样品的患者的MET基因拷贝获得或扩增(FISH)和突变(NGS)。进行的NGS分析,查询了395个基因以及涉及重排的31个基因的内含子。EGFRwt MET IHC 3+ NSCLC扩展组的接受治疗的行数不得超过三行(除非与研究赞助商讨论后接受)。其他关键纳入标准是EGFR中RECIST v1.1规定的一个或多个可测量病变wt MET IHC 3+ NSCLC扩展组和东部合作肿瘤学组(ECOG)的工作状态≤2。
最后,在截至2017年7月17日的主要分析截止日期,共有55名NSCLC患者入组:26名来自原始剂量扩大组的患者和29名来自EGFRwt MET IHC 3+组的患者。最初的扩展组中的所有26位患者均接受了胶囊治疗,其中有7位患者随后改用了片剂。在EGFRwt MET IHC 3+组中,所有患者均接受了片剂。
基线人口统计学和疾病特征列。大多数患者为白人(73%),初诊时患有IV期疾病(76%),腺癌组织学(89%),ECOG表现≤1(96%)。总体而言,有52例患者(95%)接受了一种或多种先前的抗肿瘤治疗方案,其中20例患者(36%)接受了三种或更多种方案。共有21例(38%)患者在研究开始时表现出受控的脑转移。在数据截止日期,所有患者均已停止治疗,疾病进展[38例(69%)]为主要原因,其次为AE [11例(20%)],撤回同意[4例(7] (%)],因随访而丢失[1例患者(2%)],以及由于转移至过渡研究[1例(2%)]。现在卡马替尼的价格是多少?更多详情可咨询下方微信。















请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)