2017年7月,美国食品药品监督管理局(FDA)专家对诺华公司嵌合抗原受体T细胞免疫疗法(CAR-T)技术全票通过。随后,诺华的Kymriah和Kite(Gilead)的Yescarta两个细胞治疗药物相继获批,将这一疗法实现产业化,给全球的癌症患者带来了希望。这一消息无疑给国内细胞技术业界打了一针兴奋剂。
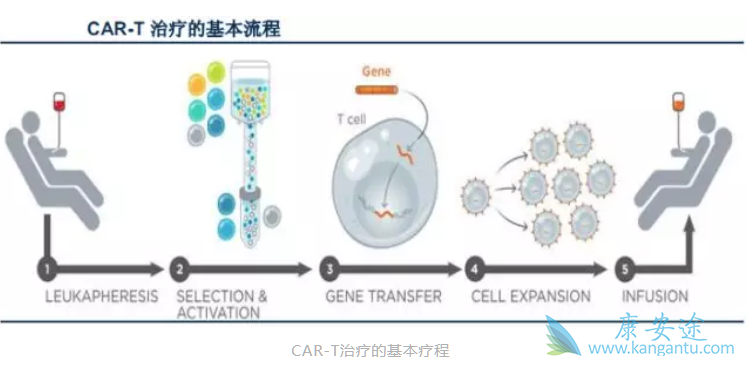
部分业内人士笑称,“隔壁老王的孩子中了状元,不明白邻居李大妈激动个啥。”然而,我却认为这种激动是在情理之中的。因为对于任何一个行业来说,政策无疑都是非常重要的导向和发展助力。2017年对生物制药、免疫治疗等领域是一个转折点,不管是美国食品药品监督管理局(FDA)、欧洲药品管理局(EMA)还是中国的CFDA,正在向行业传递一个明确的信息,“突破创新,我们将予以批准”。果不其然,在诺华“破冰”获FDA批准上市之后,细胞疗法的利好消息扑面而来。2017年12月22日,CFDA发布《细胞治疗产品研究与评价技术指导原则》并对相关问题进行解读,正式开启中国CAR-T元年,为我国细胞治疗产品作为药品规范化产业化生产拉开序幕。CAR-T作为一种新的治疗方案,它的根本原理是:利用病人自身的免疫细胞,来攻击和清除病人体内的癌细胞。近年来,CAR-T疗法广泛地被认为是治愈癌症的新曙光,尤其在急性白血病和非霍淋巴瘤等治疗领域,越来越多的成功案例让它备受瞩目。在政策落地的过程中,技术发展是其中的重要驱动。1989年,美国科学院院刊(PNAS)上首次报道了第一代CAR-T疗法。2011年以后,CAR-T疗法逐渐应用于临床试验当中。
2012年,6岁的美国小女孩艾米丽·怀特海德成为全球首位接受CAR-T疗法的儿童。5年后,已经痊愈的艾米丽被《自然》杂志评选为2017年十大人物,“一个战胜白血病的年轻女孩开启了癌症治疗新的时代”,评语如是说。当技术发展到一定程度,势必会达到一个“临界点”,实现从小众到慢慢被大众接受的过程,除了技术上的更迭加速,还在于出现了越来越多的治疗成功案例,也让患者看到了“希望”。事实上,CFDA发布的政策并非“空穴来风”,早在2016年末,CFDA就发布了第一个征求意见稿,确定CAR-T细胞治疗产品将以药物开发进行监管;2017年5月22日,科技部官网发布了《关于对国家重点研发计划干细胞及转化研究等6个重点专项2018年度项目申报指南征求意见的通知》,2017年6月6日,国家科技部和卫计委员等六部委又联合印发《“十三五”卫生与健康科技创新专项规划》。2017年进入下半年,干细胞相关政策出台愈加频繁。深圳、广州、上海分别出台了地方性政策,重点促进干细胞技术推广,海南省更是计划在全国率先开展干细胞临床应用……这些积极的信号表明,细胞治疗时代或将到来,鼓励支持的具体技术标准和细则出台已经是大势所趋。
















请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)