根据阿斯利康(AstraZeneca),高选择性,有效的BTK抑制剂的制造商,FDA已经授权acalabrutinib作为以前治疗的外套细胞淋巴瘤(MCL)患者的突破性治疗指标。
突破性指定将加快MCL中阿卡巴肽的开发和评估,是根据阿卡巴第啶开发计划的临床资料总数,包括复发/难治性MCL患者II期ACE-LY-004临床试验的结果。在FDA的行动新闻稿中,阿斯利康公司没有包含任何结果或指出,MCL中阿卡苯尿苷的具体数据将会提供。
Acerta Pharma是阿斯利康的血液学研究与开发研究中心,开发了阿卡巴特丁治疗多发性B细胞癌。阿卡巴特鲁发展计划包括慢性淋巴细胞白血病(CLL),MCL,Waldenström巨球蛋白血症,滤泡性淋巴瘤,弥漫性大B细胞淋巴瘤和多发性骨髓瘤的单一疗法和联合治疗策略,以及实体瘤中的单一疗法和联合试验。
 Acerta Pharma首席执行官Phava Borellini博士在新闻稿中说:“这是我们在血液学领域工作的一个激动人心的监管里程碑。“Acalabrutinib是一种有效的,不可逆的BTK抑制剂,对其目标具有高度的特异性。如果获得批准,这可能是患有这种破坏性疾病的患者的临床有意义的治疗选择。“
Acerta Pharma首席执行官Phava Borellini博士在新闻稿中说:“这是我们在血液学领域工作的一个激动人心的监管里程碑。“Acalabrutinib是一种有效的,不可逆的BTK抑制剂,对其目标具有高度的特异性。如果获得批准,这可能是患有这种破坏性疾病的患者的临床有意义的治疗选择。“
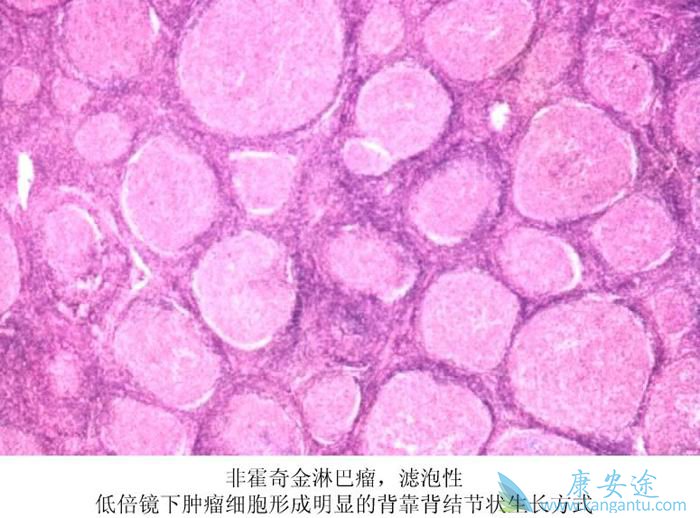
MCL是一种侵袭性B细胞非霍奇金淋巴瘤,预后不良。该病每年在西方国家占非新霍奇金淋巴瘤新发病例的6%,年发病率为每10万人0.5人,估计每10万人中有3.5人患病。
AstraZeneca全球药物开发执行副总裁兼首席医学官Sean Bohen博士说:“对于复发或不应对当前治疗的地套细胞淋巴瘤,迫切需要新的治疗方法。”“acalabrutinib的突破性治疗指南将有助于我们尽快将这种潜在的新药提供给适当的患者。”
近年来,MCL患者的治疗方案有所增加。2013年,FDA批准了接受至少1次以前治疗的MCL患者的伊布他尼(Imbruvica),并且来昔他汀(Revlimid)用于复发或其疾病在以前的治疗后进展的患者,包括至少1次硼替佐米治疗(Velcade)。
硼替佐米在2006年被批准用于以前治疗的MCL患者,并在2014年被批准用于治疗初治患者。
阿卡波他滨的可用数据在CLL和小淋巴细胞白血病(SLL)患者中表现出有希望的活性。在2016年ASH年会上提交的I / II期ACE-CL-001试验结果显示,伊豆素不耐受的CLL / SLL患者的阿卡波他滨的总体反应率(ORR)为79%。1
例有评价的29例患者,其中1例(3.4%),15例(51.7%)部分缓解(PR)为淋巴细胞增多症(PRL),7例(24.1%), ,稳定型疾病(SD)为6例(20.7%)。仅CR和PR的ORR为55.2%,为79。将PRL包含在ORR定义中时为3%。所有可评估患者达到至少SD。PRL或更好的中位数为1.9个月。
在2016年ASH年会上提出的另一份摘要中,阿卡巴特丁在同一ACE-CL-001试验中列出了Richter转化患者队列中38.1%的ORR。2
















请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)