欧洲药品管理局人类用药产品委员会(CHMP)对非小细胞肺癌(NSCLC)和尿路上皮癌中的阿替利珠单抗(Tecentriq)的适应症呈现积极的作用。

罗氏公司宣布,CHMP支持治疗患有先前治疗,局部晚期或转移性NSCLC的成人和针对局部晚期或转移性尿路上皮癌的成人的以前接受铂类化疗或不符合顺铂化学疗法治疗的成人的替奈唑单药治疗。
 欧盟委员会现在将作出最终批准,决定在欧盟使用阿替唑单抗。
欧盟委员会现在将作出最终批准,决定在欧盟使用阿替唑单抗。
“这个积极的CHMP意见对于晚期肺癌或膀胱癌患者来说是个好消息,罗氏首席医疗官兼全球产品开发负责人Sandra Horning表示,尽管近期发展,这些癌症患者的长期存活率也低于其他常见癌症。
“我们感到鼓舞的是,CHMP考虑了Tecentriq数据的总体情况,包括关键临床终点的重要性,如长期反应。” CHMP基于对III期OAK和II期NSCLC结果的意见POPLAR研究以及III期IMvigor211和来自尿路上皮癌单臂II期IMvigor210研究的队列1和2的结果。
OAK是一项全球开放标签的随机对照试验,用于比较阿替唑单抗多西紫杉醇的疗效和安全性。患者每3周(n = 425)每3周(n = 425)或75 mg / m 2的多西紫杉醇IV被分配到1200mg阿替唑单抗。
实验组的患者与多西紫杉醇相比,具有4.2个月的总体生存(OS)益处(13.8 vs 9.6个月;风险比[HR],0.73; 95%CI,0.62-0.87;P= 0.0003)。12个月(55%vs 41%)和18个月(40%vs 27%)的总体生存率也有利于阿替利珠单抗。实验组中位时间为13.8个月,多西他赛组为9.6个月。
Atezolizumab也与国际,随机,开放标签,对照,II期POPLAR研究中的优异OS相关。先前使用铂类化疗(N = 287)治疗晚期NSCLC的患者随机分配1:每3周1至1200mg阿替唑珠单抗,直至每3周周期的第1天临床获益减少75mg / m2或多西他赛 75mg / m2,直至疾病进展为止。
在22个月的中位生存率随访和总共200次观察到的死亡中,阿替佐珠单抗的中位OS为12.6个月,而分配给多西紫杉醇的患者为9.7个月(HR,0.69; 95%CI,0.52-0.92)。总体反应率(ORR)为15.3%,而赞比亚唑替沙星为14.7%。中位反应持续时间(DOR)为18.6个月,而赞比亚替利珠单抗7.2个月。
调查人员评估了阿替佐珠单抗与伏立佛胺,紫杉醇或多西紫杉醇在IMvigor 211(N = 931)中的安全性和有效性。在铂类化疗期间或之后进展的转移性尿路上皮癌患者符合资格。
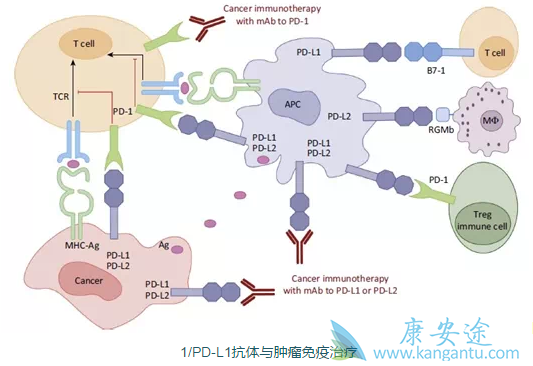
研究人员在由PD-L1表达定义的研究群体中连续评估OS的主要功效终点。测试的第一批患者是PD-L1表达水平最高的患者(肿瘤浸润性免疫细胞[IC] 2/3),其次是具有任何可观察到的PD-L1表达水平(IC1 / 2/3)的患者,然后是意向治疗人群(ITT)。
阿替珠单抗未能达到研究的主要终点。IC2 / 3(≥5%)组的平均OS为11.1或阿唑替珠单抗化疗组为10.6个月(HR为0.87; 95%CI为0.63-1.21)。ITT人群的中位OS轻微偏爱阿替唑单抗,8.6和8.0个月(HR,0.85; 95%CI,0.73-0.99)。
IC2 / 3(≥5%)人群首先需要达到统计学意义,其次是IC1 / 2/3(≥1%)组和ITT组。由于IC2 / 3群体的OS无统计学意义,IC1 / 2/3和ITT群体的统计学显着性差异无统计学意义。
局部晚期或转移性尿路上皮癌患者不符合含顺铂化疗,先前未经治疗或新辅助化疗后至少12个月发生疾病进展,符合IMvigor210标准。
队列1(N = 119)的ORR为22.7%。在PD-L1表达≥5%的患者中,ORR为28.1%,PD-L1表达≥1%的患者ORR为23.8%。有11(9.2%)完成答复和16(13.4%)部分回应。
在队列2(N = 310)中,通过使用RECIST v1的独立审查评估了主要功效终点。
在21.1个月的生存随访中位数持续时间方面,PD-L1表达IC2 / 3(≥5%),19.3%患者的RECIST v1.1确诊ORR分别为28.0%(95%CI,19.5-37.9)在所有患者中,PD-L1表达IC1 / 2/3(≥1%)和15.8%(95%CI,11.9-20.4)患者的百分比(95%CI,14.2-25.4),主要分析人群的前850名随机患者。
PD-L1表达患者PD-L1表达≥5%,23.7%(95%CI,18.1-30.1)患者的确诊患者的ORR为29.0%(95%CI,20.4-38.9)≥ 1%,19.7%(95%CI,15.4-24.6)。全民接受RECIST v1.1的完全反应率为6.1%(95%CI,3.7-9.4)。
对于队列2,在任何PD-L1表达亚组或全能者中未达到中值DOR。然而,PD-L1表达1%的患者确实达到中位DOR(13.3个月; 95%CI 4.2-未达到)。所有人的操作系统率为12个月,为37%。
安全性结果基于2160例转移性尿路上皮癌和NSCLC患者的汇总数据。最常见的不良反应为疲劳(35.4%),食欲下降(25.5%),恶心(22.9%),呼吸困难(21.8%),腹泻(18.6%),发热(18.3%),皮疹(18.6% ,呕吐(15.0%),关节痛(14.2%),乏力(13.8%),瘙痒(11.3%)。
















请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)