在过去十年中,超过 10 个可靶向的致癌驱动基因已在非小细胞肺癌 (NSCLC) 中得到验证。间变性淋巴瘤激酶 (ALK) 和 ROS1 激酶是与 ALK 和 ROS1 重排的 NSCLC 相关的两个新驱动基因。据报道,克唑替尼(Crizotinib)对 ALK 和 ROS1 的抑制在这些患者中非常有效且耐受性良好。然而,对克唑替尼的耐药性在治疗后数年出现,并且已经做出越来越多的努力来克服这个问题。在这里,我们回顾了 ALK 和 ROS1 的生物学及其在癌症进展中的作用。我们还总结了正在进行和已完成的验证 ALK 和 ROS1 作为癌症治疗靶点的临床试验。在综述的最后一部分,我们将讨论克唑替尼耐药的分子机制和克服它的重点方法。
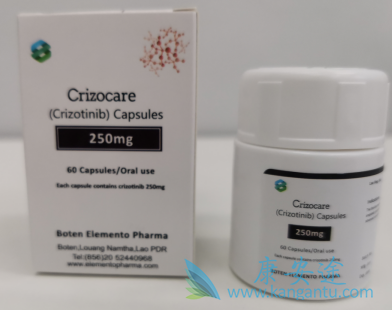
2007 年在肺癌中发现转化棘皮动物微管相关蛋白样 4-间变性淋巴瘤激酶 (EML4-ALK) 融合基因,表明 ALK 不仅是非常罕见的血液系统癌症的驱动基因,还可以作为对于非小细胞肺癌(NSCLC)治疗。ALK 存在于大约 3% 至 5% 的 NSCLC 患者中,仅在美国每年就有大约 8,000 名患者。在 NSCLC 中 ALK 重排的报告发布几个月后,科学家们发现了 NSCLC 中 ROS1 癌基因的重排。克唑替尼是一种多靶点酪氨酸激酶抑制剂,在携带 ALK 和 ROS1 重排的 NSCLC 患者中具有很高的临床效率。鉴于其在 I 期和 II 期临床试验中的高效和安全性,克唑替尼已获得美国食品药品监督管理局(FDA)的加速批准,作为晚期 ALK 重排 NSCLC 的一线治疗药物。
尽管大多数 ALK 和 ROS1 重排的 NSCLC 患者从克唑替尼中获益,但对靶向治疗的耐药性仍然是一个常见的临床挑战。随着 EGFR 酪氨酸激酶结构域内“看门人”T790M 突变的出现,对 EGFR 抑制剂产生耐药性;类似地,对克唑替尼的抗性部分源于抗性突变的出现。T790M存在于一半的EGFR靶向耐药病例中,是常见的EGFR耐药突变。2010 年描述了第一个在克唑替尼治疗后复发的 ALK 重排 NSCLC 患者。对该患者的胸腔积液标本进行 DNA 深度测序,确定了另外两个突变,L1196M 和 C1156Y。L1196M 和 C1156Y 的异位表达导致 EML4-ALK 转化的 Ba/F3 细胞对克唑替尼产生耐药性,表明这些肿瘤来源的 L1196M 和 C1156Y 突变降低了肿瘤对 ALK 抑制剂的敏感性 。在很大程度上已经确定了潜在的机制。与 EGFR 中的 T790M 突变类似,“守门人”L1196M 突变在 ALK 激酶的 ATP 结合域中添加了新的庞大残基,阻碍了克唑替尼的结合。
C1156Y虽然不是“看门人”突变,但也会引起克唑替尼与ALK的错位,间接导致ALK结合腔的构象变化,导致克唑替尼(Crizotinib)敏感性显着降低。然而,EGFR 耐药和 ALK 耐药之间的一大差异是仅在 ALK 抑制剂耐药患者中检测到多重耐药突变。除了L1196M和C1156Y,G1202R,S1206Y,F1174C,F1174L,D1203N,I1171T,1151T插件,L1152P和G1269A突变也胙克里唑替尼抗性。迄今为止,已经在大约 25% 的克唑替尼治疗失败的患者中发现了耐药突变。2013 年,在 ROS1 重排患者中也报告了由突变引起的对克唑替尼的耐药性。重复活检标本显示 ROS1 中存在 G2032R 突变,这在预处理标本中未检测到。患者死亡后,尸检结果显示所有病变部位均有G2032R突变,提示G2032R克隆的扩增和扩散可能是导致该患者对克唑替尼耐药的原因。与 EGFR 和 ALK 中的“看门人”突变不同,G2032R 突变位于 ROS1 激酶结构域的溶剂前沿,类似于 ALK 中的 G1202R 抗性突变。微信扫描下方二维码了解更多:













请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)