MET基因扩增导致MET蛋白的过度表达和自身磷酸化,与细胞系中MET抑制剂的敏感性有关。此外,在两个同时表达MET及其配体HGF的临床前模型中也已经报道了对卡马替尼(inc280)的反应。为了以无偏见和系统的方式评估对卡马替尼反应的预测指标,我们在“癌细胞系百科全书”(CCLE)项目中测试了卡马替尼针对600多个特征明确的癌细胞系的活性。细胞系筛选以高通量形式独立进行了两次,其中在3天的孵育期后生成了卡马替尼的剂量反应曲线。经过质量控制后,我们获得了总共605个细胞系的解释结果(第一个屏幕中为458个细胞,第二个屏幕中为364个细胞,重叠217个细胞系)。
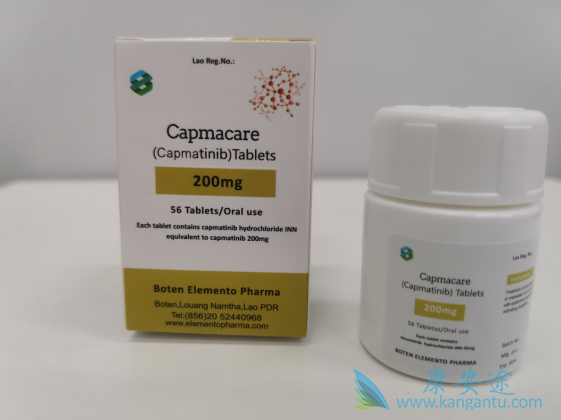
我们考虑了拟合的乙状结肠剂量反应曲线的最大作用(Amax)和EC50(拐点),以确定敏感性。用低严格性(甲最大≤-25%和拐点≤100纳摩尔/ L),我们总共13个应答或部分应答者观察到的所有测试的细胞系中。在两种情况下测试的217种细胞系的卡马替尼反应方面,两个筛选在很大程度上是一致的,不同的是两个细胞系在一个筛选中得分为中度敏感而在另一个筛选中完全耐药。
有趣的是,除了这两个不和谐线的所有响应的细胞系,其特征在于两个基因组谱的一个:(i)MET基因扩增,从而导致显着的METmRNA过度表达或(ii)所述的高表达MET的配体HGF。HGF的表达癌细胞系的表达可能表明激活这些细胞中MET的自分泌环。实际上,我们在细胞培养上清液中发现了HGFmRNA表达与HGF蛋白含量之间的良好相关性。自分泌类别的七个细胞系中有四个来自胶质母细胞瘤,这可能与胶质母细胞瘤频繁出现包含MET和HGF的7号染色体区域的观察有关。
在低浓度(拐点<10 nmol / L)下,只有两种已知对MET有依赖性的MET扩增细胞系显示出对卡马替尼(Amax接近-100%)的深刻反应。所有表达HGF的细胞系和两个MET扩增的细胞系均表现出部分应答(Amax> -60%)。在某些表达HGF的细胞系中,剂量反应曲线很浅,这表明在筛选条件下MET抑制后,生长仅适度降低。
为了研究这些观察是否可推广到选择性MET抑制剂,我们将卡马替尼的CCLE筛查结果与其他三种MET抑制剂的结果以相同的筛查形式进行了组合,每种抑制剂均像卡马替尼一样独立测试了两次:克唑替尼,JNJ-38877605和PF-4217903。后两种化合物是具有类似于卡马替尼的化学结构的高选择性MET抑制剂。对于克唑替尼,ALK可以解释细胞活性此综合分析不考虑易位。可以分析总共709个细胞系,这些细胞系已在多个屏幕上进行了测试。对敏感性细胞系(“命中”)的评分与卡马替尼相同,但使拐点截止值适应于其他抑制剂相对较低的效力。
观察到总共有16种命中,并用一种以上的MET抑制剂评分,其中包括10种先前单独用卡马替尼鉴定的命中(总命中率16/709 = 2%)。所有命中都与MET的高表达和/或拷贝数相关,或者它们与MET和HGF共表达。当定义由具有最低值的命中值指导的那些生物标志物的阈值时,我们注意到具有高MET拷贝数(扩增)的细胞系中的命中率相对较高(4/6 = 67%),随后是显示MET过表达(5/9 = 56%,这五个中的四个也被扩增),这表明这些生物标记(大部分重叠)可能是选择性MET抑制剂的合适预测标记。相反地,与所述细胞系中MET / HGF共表达(推定的自分泌),命中率较低(11/32 = 34%),这可能是由于至少两个因素:在该类别中最大的生长抑制作用大多是适度的,这使得在高通量筛选中进行检测的可能性较小。HGF介导的MET激活在这些细胞系的一部分中不导致MET依赖性生长。
临床上,在肺癌患者的肿瘤中含有导致MET外显子14跳过的突变,就观察到了对MET抑制剂的反应。在我们测试的细胞系中,两个模型包含此类突变:胃癌细胞系Hs 746.T和肺癌细胞系NCI-H596。Hs 746.T在体外对卡马替尼治疗有反应,但MET在该细胞系中也高度扩增。因此,在该模型中很难评估MET外显子14跳跃对卡帕替尼敏感性的贡献。NCI-H596细胞在体外对MET抑制有抗性。然而,在该细胞系中,我们观察到了响应HGF刺激的更持久的MET磷酸化,这与报道的MET外显子14缺失的功能性结果一致。现在卡马替尼价格是多少?更多详情可咨询下方微信。














请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)