2019年5月24日,美国FDA批准了诺华旗下的AveXis Inc.公司开发的Zolgensma(onasemnogene abeparvovec-xioi)。Zolgensma成为第一款获批用于治疗2岁以下脊髓性肌萎缩症(spinal muscular atrophy,SMA)患者的基因疗法。这是一种严重的罕见病,是婴儿死亡的主要遗传原因。
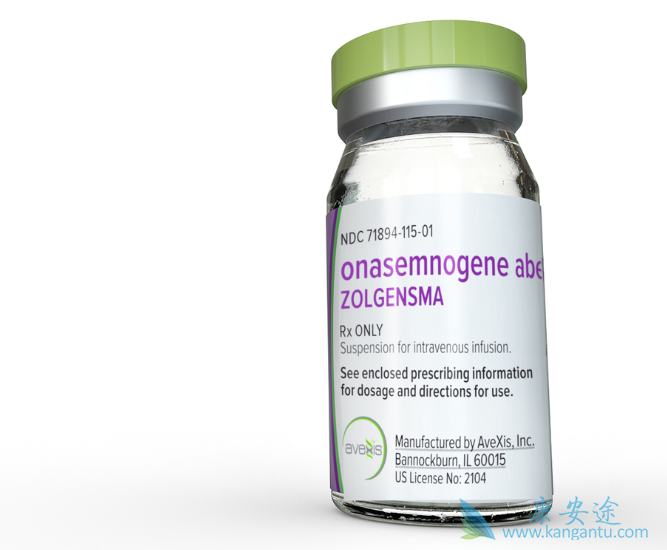
“今天的批准是又一个里程碑,显示了治疗多种疾病的基因疗法和细胞疗法的变革性力量。” FDA代理局长Ned Sharpless医学博士表示。“随着每一项新的批准,我们看到这个令人兴奋的科学领域继续跨越概念阶段而变为现实。基因疗法产品可能会改变那些可能面临绝症、死亡的病人的生命,这为他们的未来带来了希望。FDA将继续使用旨在推进创新及安全有效治疗方案的审查途径,加快开发满足未满足医疗需求的产品。”美国FDA生物制品评估与研究中心主任Peter Marks博士表示,“患有SMA的儿童在基本生活功能方面遇到困难。大多数患有这种疾病的儿童由于呼吸衰竭而夭折。SMA患者现在有另一种治疗选择,它可以最大限度地减少SMA的进展并提高生存率。今天的批准证明了这一有前途的新医学领域的持续发展势头以及FDA对支持和帮助加快这些产品开发的承诺。”
FDA之前授予该申请快速通道、突破性疗法和优先审评资格。Zolgensma还获得了孤儿药认定。诺华旗下的AveXis Inc.公司因而获得了一张宝贵的罕见儿科疾病优先审评券(PRV)。这张审评券可能价值连城。同一天,FDA批准了诺华公司的两款产品。另一款产品是Piqray(alpelisib),首个乳腺癌PI3K抑制剂,这也是FDA RTOR审评改革的首个成果。了解详情,请阅读药时代同日发表的文章,“FDA批准诺华的Piqray(alpelisib),首个乳腺癌PI3K抑制剂,FDA RTOR审评改革的首个成果”。













请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)