索马鲁肽Semagalutide的发现历程?艾塞那肽和利拉鲁肽的成功临床试验导致人们对基于 GLP-1 的疗法的兴趣增加。由于每日注射是一些 T2D 患者的障碍,因此重点是提高便利性,理想情况下使用可以每周注射一次的有效 GLP-1 类似物。已经探索了多种技术来发现和开发适用于每周一次 (OW) 给药的 GLP-1RA。缓释是临床试验中最先评估的方法之一,并导致艾塞那肽胶囊制剂获得批准:艾塞那肽缓释 (ER)。在临床试验中评估 OW 剂量的第一个基于人的 GLP-1RA 是他司鲁肽(BIM-51077,Aib8,35 GLP-1酰胺,罗氏)。Aib8 保护他司鲁肽免于 DPP-IV 降解。尽管以氯化锌为基础的他司鲁肽制剂,促进皮下沉淀,显示出有希望的结果,3期试验已经完成,但由于一些过敏性休克病例而停止提交批准。其他方法需要通过将肽与大的、稳定的血浆蛋白如白蛋白(阿必鲁肽)或 IgG 的 Fc 域(度拉鲁肽)共价融合来限制 GLP-1 或基于毒蜥外泌肽的化合物的肾脏清除率。
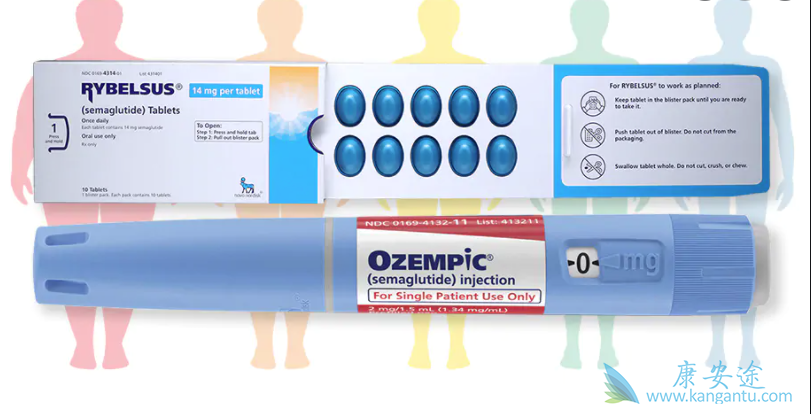
在诺和诺德,这个想法是建立在与白蛋白的可逆结合之上,作为 GLP-1 类似物全身性延长的解决方案。早期研究中发现的主要挑战是,由于与白蛋白结合和与受体结合之间存在竞争,因此与白蛋白的强结合对 GLP-1R 化合物的效力产生负面影响。理论是只有血浆中未与白蛋白结合的游离部分才能激活 GLP-1R。因此,对白蛋白的亲和力越强,GLP-1 肽的游离和活性循环部分越小。这种现象以前曾在利拉鲁肽类似物上观察到,其中存在明显趋势,更长的脂肪酸,对白蛋白的亲和力提高,与 GLP-1R 的效力减弱有关 。这些发现得到了阿必鲁肽研究的进一步支持,其中 GLP-1RA 与白蛋白共价结合的效力需要高剂量才能获得临床相关疗效。阿必鲁肽具有 Gly8 GLP-1(7-36) 的串联重复序列。串联重复序列的目的可能是通过在白蛋白和远端 GLP-1 肽之间产生更长的距离来提高对 GLP-1R 的亲和力。氨基酸取代(Ala8 至 Gly8)保护阿必鲁肽在 N 端免于 DPP-IV 降解。最后,串联重复序列与 HSA 的 N 端融合以延长阿必鲁肽的半衰期。然而,虽然半衰期延长至 6-8 天,使其适用于 OW 给药,但阿必鲁肽的效力显着降低(阿必鲁肽的 GLP-1R 亲和力为 20 nM,而艾塞那肽的亲和力为 0.02 nM),很可能是由于 Gly8 修饰和与 HSA 的共价连接的组合。
在设计索马鲁肽时,一个现实的问题是是否有可能稳定 GLP-1 类似物对抗全身清除率,以达到足以控制 OW 给药后血糖的血浆水平。利拉鲁肽的初步发现,使用体外和体内(动物模型)GLP-1R 测定,表明在白蛋白存在的情况下实现长血浆半衰期和足够高的 GLP-1R 亲和力之间的最佳平衡具有挑战性与艾塞那肽相比,利拉鲁肽的临床剂量相对较高(每天一次高达 1.8 毫克)证明了这一点(2*20 微克)。在解决这一挑战的综合研究计划中,策略是使肽尽可能与利拉鲁肽和内源性 GLP-1 相似,以避免免疫原性方面的不必要风险。因此,肽主链仅在第 8 位被修饰,其中 Ala 被 Aib 取代,以前显示出对 DPP-IV 切割具有抗性并具有高 GLP-1R 亲和力。该策略的第二部分是寻找具有高白蛋白亲和力的脂肪酸的最佳组合,通过与水相容的化学接头连接到 GLP-1,以确保衍生肽在白蛋白存在下具有高 GLP-1R 效力.系统地评估了几种脂肪酸和接头。根据将棕榈酸酯用作白蛋白标签的接头研究,观察到“OEG”接头的引入导致高受体效力和白蛋白亲和力。为了增加白蛋白亲和力,除了用棕榈酸酯获得的亲和力之外,还研究了脂肪酸的长度和类型。将脂肪酸的长度从 C16(棕榈酸酯)增加到 C18 或 C20 不会产生所需的特性。具有用于酰胺连接到接头的近端脂肪酸以及远端脂肪酸的二脂肪酸被证明是获得高白蛋白结合和 GLP-1R 效力的解决方案。
对 C12 至 C20 脂肪酸衍生物的系统测试表明,C18 二酸与 γGlu-2xOEG 接头一起产生最高的白蛋白亲和力和 GLP-1R 效力。衍生物的构效关系清楚地表明脂肪二酸的长度很重要,并且在司美鲁肽中使用的 C18 二酸是最佳选择。随着从 C12 到 C18 的二酸中碳原子的增加,GLP-1R 效力的增加有明显的趋势,但当使用更长的(>C18)二酸时,这种趋势被逆转。在受体结合试验中,当加入白蛋白时,C18 二酸也显示出最高的亲和力变化,表明白蛋白亲和力强。
对于两亲性和亲脂性肽衍生物,直接测量白蛋白亲和力具有挑战性。然而,使用分析超速离心法测量相对白蛋白亲和力是可能的。脂肪酸衍生肽都具有比天然 GLP-1 更高的白蛋白亲和力。同样清楚的是,与利拉鲁肽相比,包含二酸的衍生物具有更高的白蛋白亲和力,并且二酸的长度很重要。
虽然不可能获得司美鲁肽的晶体结构,但与 GLP-1R 复合的未酰化司美鲁肽肽骨架的结晶表明整体结构与天然 GLP-1(7-37) 的结构相同。在这两种结构中,Lys26 与 GLP-1R 的 Glu128 相互作用,尽管先前的受体诱变研究表明这种相互作用并不重要,而且 Lys26 的酰化对受体亲和力的影响很小。GLP-1(7-37)-OH 的天然 Lys34 在与 GLP-1R 胞外域复合时显得高度灵活,而索马鲁肽的 Arg34 采用更明确的面向 Glu27 的构象.在此结构中,水分子由 Arg34 的胍基、Glu27 的骨架羰基和羧基配位。水分子似乎介导了 Arg34 和 Glu27 之间的静电相互作用。Arg34 被引入利拉鲁肽以实现 Lys26 的位点特异性酰化,并且对与 GLP-1R 的结合没有明显影响。
在选择 OW 索马鲁肽的筛选程序中,体内动力学和动力学也是关键的考虑因素。早期项目包括大鼠和小型猪的 PK 研究,以及 db/db 小鼠的功效,以选择结合长 PK 特征和高体内GLP-1R 效力的衍生物。对于基于体外试验选择的二酸衍生肽的子系列,体内特性显示出在很大程度上是一致的。在大鼠中,衍生物的半衰期随着脂肪酸长度的增加而增加,从 C12 二酸的 1.2 小时到索美鲁肽的 7 小时左右,C20 二酸的半衰期甚至更长。由于大鼠的 PK 数据并不总是能反映人类的 PK 数据,因此还在小型猪中测试了最有希望的衍生物;这些研究证明了比在大鼠中观察到的更长的半衰期。小型猪与大鼠的研究结果的另一个差异与 C20 二酸衍生物的半衰期有关;虽然这种衍生物在大鼠中的半衰期比 C18(索马鲁肽)长,但在小型猪中的表观半衰期与皮下给药后约 75 小时和静脉给药后 55 小时的表观半衰期相似。
索马鲁肽的功效最初在 db/db 小鼠中得到证实。最有希望的衍生物的剂量反应研究证实了高效力和作用持续时间,ED50 低于 2 nmol/kg(计算为皮下给药后 48 小时血糖的曲线下面积 [AUC]).基于这项研究,选择司美鲁肽进行更全面的研究,随后作为在临床试验中评估的化合物。












请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)