尽管存在相当长一段时间的疑问,但以上讨论的数据将MET外显子14跳过突变确立为主要的致癌驱动因子,可以有效地靶向NSCLC。这些改变存在于IV期非鳞状NSCLC病例中的3-4%,并且与EGFR,ALK,ROS1和BRAF中已确定的驱动基因突变相互排斥。此外,使用选择性小分子MET抑制剂观察到的ORR和DCR很高,并且与批准的EGFR-,ALK-,ROS1-和BRAF-TKIs观察到的范围相同。根据这些数据,对MET进行常规测试应建议在第IV期非鳞状非小细胞肺癌中跳过第14外显子。此外,GEOMETRY Mono-1数据显示未经治疗的卡马替尼(INC280)的反应率明显高于未治疗的患者,表明MET外显子14跳跃突变最好在基线进行分子评估。这些变化的测试可以包含在更广泛的DNA测序面板中。但是,考虑到外显子14跳跃改变的各种基因组位置,现在正在评估基于RNA的方法,以便将来更全面地捕获MET外显子14跳跃事件。
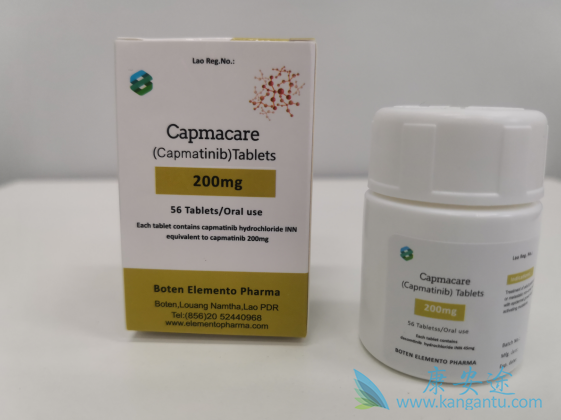
因此,MET外显子14跳过突变是对卡马替尼反应的明确生物标记。来自GEOMETRY Mono-1试验的初步数据表明,独立审查委员会分析的反应在39.1%的预治疗患者和71.4%的未治疗患者中被注意到。这些反应是持久的,治疗前患者的DOR中位数为9.72个月,初治患者为8.41个月。然而,在该分析的截止日期,DOR和PFS数据尚不成熟。卡马替尼的安全性良好,并且来自GEOMETRY Mono-1试验的未来数据将揭示与食物一起服用时该药物的耐受性是否进一步提高。
现在,研究应开始集中于内源性和获得性耐药的机制,以进一步改善该分子定义的患者亚组的治疗选择。初步研究结果在ASCO 2019年会议上进行了介绍。对于内在抗性,不存在MET蛋白表达或KRAS途径激活均具有阴性预测价值。注意到有MET表达的患者中有63%(7/11)对MET-TKI有反应,而没有MET表达的患者中有0%(0/5)。据报道有29例患者获得了耐药,其中9例已配对了治疗前和治疗后的样本进行分析。在2例患者中发现MET途径的靶点耐药(继发METD1128N突变,HGF扩增),有5例未达到目标(1个KRAS突变,1个RASA1突变,2个MDM2扩增和1个EGFR扩增)。
METGCN的变化是MET抑制剂活性的另一种潜在的预测性生物标志物,尽管目前其特征不如外显子14跳过改变那么好。卡马替尼在MET扩增的肿瘤中的疗效仍有待确定。但是,克唑替尼在MET扩增较低或中值的肿瘤中的经验表明,与MET突变的肿瘤相比,在这种情况下,克唑替尼具有较低的应答率和较短的生存期。尽管对高MET的期望扩增更高,这个潜在的生物标记物和对MET抑制剂相关反应的最合适定义需要进一步阐明。基于令人失望的数据,已经放弃了研究IHC和低GCN改变(GCN <10)作为预测对MET抑制剂反应的生物标志物的研究。
MET现在也是EGFR突变型NSCLC的关键靶标。特别是,MET扩增已被确定为对EGFR-TKI耐药的重要驱动力,尤其是在一线奥西替尼复发时。随着奥西替尼作为EGFR-TKI治疗的可获得性,T790M不再像预期的第一代或第二代TKI那样成为耐药机制,据报道MET扩增出现在15%的耐药病例中。然而,由于这些数据是通过液体活检分析获得的,因此这可能是对MET驱动的耐药性真实频率的低估。实际上,由于存在来自正常组织的DNA,因此基于NGS的检测对血浆的敏感性可能比组织分析欠佳。技术改进可能会在获得性抗EGFR-TKIs的意义上提供更多关于MET重要性的见识。
此外,MET扩增可能与激活的EGFR突变在基线共存,应评估其在早期EGFR-TKI衰竭中的作用。最近的报告显示,在EGFR-TKI治疗之前同时存在MET扩增的患者中,对EGFR-TKI的反应欠佳。重要的是,该报告中描述的更短的治疗失败时间只有在MET扩增通过GCN≥5和MET / CEP7比率≥2进行分类而不是单独通过GCN≥5进行分类时才观察到。这一发现再次强调了对MET扩增进行明确验证的定义以供患者选择的高度需求。但是,如果得到证实,则MET的基线状态应包括在将来的试验中,以研究从EGFR-TKIs开始起联合应用MET阻滞是否会延迟耐药性的发作。如果需要卡马替尼的购买,更多详情可咨询下方微信。














请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)