一项随机、双盲、安慰剂对照、多中心、名为REVERSE的3期临床研究将在约540例经活检确诊为非酒精性脂肪肝炎(NASH)引起的肝硬化患者中评估奥贝胆酸用于NASH引起的代偿性肝硬化受试者的有效性和安全性。奥贝胆酸是目前唯一获得FDA授予突破性疗法的在研NASH药物,随着3期临床研究REGENERATE和REVERSE的进行,我们有望将首个获批的疗法提供给患有肝纤维化和肝硬化的NASH患者,因为他们发生肝功能衰竭的风险较高。

REVERSE试验将在北美、欧洲、澳大利亚和新西兰现场进行。主要终点是在治疗12个月后,使用NASH临床研究网络(CRN)评分系统评价,肝纤维化组织学至少改善1级的受试者比例。患者将以1:1:1的比例随机分配到三个治疗组之一,分别给予每日一次奥贝胆酸 10mg,每日一次奥贝胆酸 10mg,但在三个月时增加至25mg,或者安慰剂。成功完成REVERSE双盲阶段的患者将有资格再参加最长12个月的开放标记扩展阶段试验。
该双盲试验的结果将作为奥贝胆酸获得在美国和国际市场批准用于治疗具有代偿性肝硬化NASH患者的基础。为了符合法规要求,上市后将设计随后的试验,目的在于确定在更宽的NASH肝硬化患者人群中的临床获益。由于NASH的发病机制是复杂且多因素的,所以正在进行的II/III期临床试验中有各种治疗方法,包括针对脂肪变性和脂肪生成、免疫调节、氧化应激、细胞凋亡和纤维化的药物。非酒精性脂肪性肝炎(NASH)的高发病率及特效药的缺失,使得NASH药物具有广阔的开发前景,市场潜力巨大。
详情请访问 丙肝 http://www.kangantu.org/hcv/








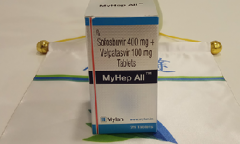

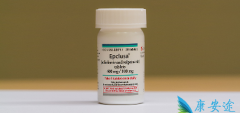
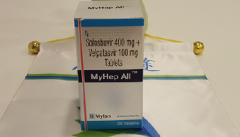
请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)