日前,诺华(Novartis)宣布,美国FDA批准该公司的Promacta(eltrombopag)扩大适应症范围,用于作为一线疗法,与标准免疫抑制疗法(IST)联用,治疗成年和儿童严重再生障碍性贫血(SAA)患者。同时,FDA授予该疗法突破性疗法认定,用于治疗接受放疗患者出现的血小板水平降低。Promacta是美国新确诊SAA患者在数十年来获得的第一款新疗法。
SAS是一种危及生命的罕见血液疾病。患者的骨髓无法生成足够的血红细胞、白细胞和血小板,因而会出现失能性症状和并发症,包括疲惫、呼吸困难、重复感染、异常淤青和出血。历史上,SAA通常是致命疾病,患者会因为感染或大出血而死亡。
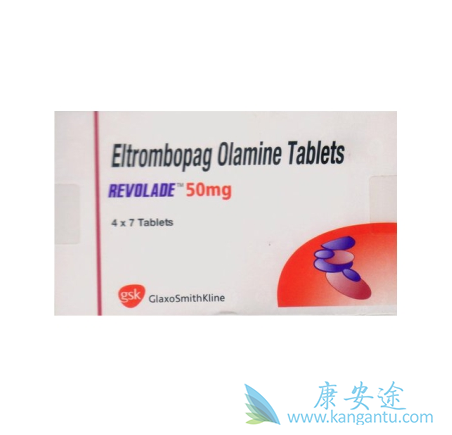
Promacta在美国以外地区的商品名为Revolade(艾曲波帕片),它是一种口服血小板生成素受体激动剂(TPO-RA)。它可以刺激骨髓生成血小板,已经获得FDA批准用于治疗对免疫抑制疗法响应不良的SAA患者,并且可以用于治疗对其它疗法响应不良的慢性免疫性血小板减少症(ITP)患者,和由于慢性丙型肝炎病毒感染而血小板减少的患者。
这一批准是基于诺华公司对美国国家心肺血液研究所(NHLBI)进行的研究的数据分析。这项研究表明在从未接受过IST疗法的SAA患者中,44%(95% CI: 33, 55)的患者在接受Promacta与标准IST疗法6个月后达到完全缓解。这一数值比历史上观察到的IST单独疗法达到的完全缓解率高27%。联合疗法在6个月时的总缓解率为79%(95% CI: 69, 87)。
更多新闻请您访问 肿瘤 http://www.kangantu.org/









请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)