这项II期研究的目的是确定MET酪氨酸激酶抑制剂卡马替尼(INC280)在MET失调的晚期肝细胞癌(HCC)患者中的临床活性,并评估安全性,药代动力学以及生物标志物与反应的相关性。卡马替尼(INC280)在生化和细胞分析中是一种高效且选择性的MET抑制剂,在耐受性良好的剂量下,可导致动物中MET依赖的肿瘤模型消退。此外,已证明MET扩增的实验性HCC肿瘤对卡马替尼高度敏感。
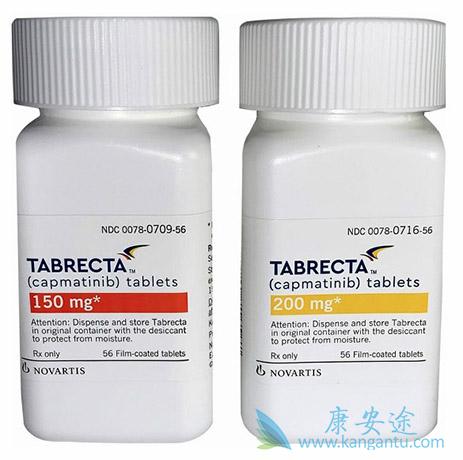
在对晚期实体瘤患者进行的I期临床研究中,确定了建议的II期建议剂量(RP2D)每天两次,每次两次(BID;胶囊),每次400 mg BID(片剂),并且卡帕替尼被证明具有可容忍的安全性。初步的抗肿瘤功效报道患者MET-失调的非小细胞肺癌,特别是患者具有高水平的MET扩增的,外显子MET 14缺失突变,或二者。本研究是一个II期,开放标记,单组,在晚期HCC 卡马替尼的多中心研究,并证实谁收到事先没有全身性治疗。
这项II期,开放标签,单臂研究在剂量确定阶段每天评估两次口服卡马替尼,使用回归模型进行剂量过量控制,安全性,药代动力学和药代动力学逐步升级信息,以确定推荐的扩展剂量(RDE),以评估MET失调的HCC患者的疗效。报告的次要目标是进一步评估卡马替尼在晚期HCC和MET失调患者中的临床活性,其次要终点是总体缓解率和疾病控制率。其他次要目标包括安全性评估,药代动力学(PK)以及血清HGF水平与临床反应之间的相关性评估。符合条件的患者年龄小于18岁,不适合晚期HCC,或者在局部治疗后进展。此外,要求患者目前处于Child–Pugh A级无肝病的肝硬化状态,东部合作肿瘤小组的表现状态为0-2。关键的排除标准包括先前的HCC全身化疗或分子靶向治疗,之前以MET靶向或HGF靶向治疗,在给药前不到4周完成的局部治疗,以及任何相关的大于1级的急性毒性 ,
共有38例患者接受了治疗。在剂量确定阶段,患者接受卡马替尼300 mg BID胶囊(n = 8),在扩展阶段,患者接受600 mg BID胶囊(n = 28)或400 mg BID片剂(n = 2)(基于BLRM)和其他相关的临床数据。在治疗的前28天未观察到预定的合格不良事件(AE),RDE为600 mg BID胶囊(相当于400 mg BID片剂的药代动力学)。最常见的因果不良事件是恶心(42%),呕吐(37%)和腹泻(34%)。在扩展阶段,在10例MET高肝癌患者的亚组中,总缓解率为30%,包括1次持续完全缓解(> 600天)和2次部分缓解。
RDE的单药卡马替尼具有可控的安全性,是可以接受的。在一部分MET失调(MET高)HCC患者中观察到抗肿瘤活性。如果您有需要购买卡马替尼,更多详情可咨询下方微信。













请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)