1. 基因疗法:致命脑瘤基因疗法获FDA突破性疗法资格认定
日前,处于临床阶段的癌症基因疗法公司Tocagen宣布,美国FDA已授予其在研疗法Toca 511 & Toca FC突破性疗法资格认定,用于治疗复发性高级别胶质瘤(high grade glioma)。目前,Toca 511 & Toca FC已处于2/3期临床试验阶段,用于测试其对发生第一或第二次复发的胶质母细胞瘤(glioblastoma)以及正接受手术的间变性星形细胞瘤(anaplastic astrocytoma)患者的疗效。

Tocagen的这一在研疗法是Toca 511和Toca FC的组合。Toca 511是一种用于注射的逆转录病毒复制载体(RRV),其编码可将前药激活的胞嘧啶脱氨酶(CD),后者源自酵母,不见于人体内。在被选择性递送至癌细胞后,感染的癌细胞携带有CD基因并可产生CD酶。Toca FC则可口服,为5-氟胞嘧啶(5-FC)的缓释制剂,是抗癌药物5-氟尿嘧啶(5-FU)的无活性前药。在使用时,口服给予的Toca FC被吸收进入血液循环,并很容易穿过血脑屏障而扩散到脑部的癌细胞中。5-FC在由Toca 511感染的癌细胞内被CD酶转化为5-FU。
以这种方式产生的5-FU具有双重作用机制:直接杀死RRV感染的癌细胞和相邻的未感染癌细胞,并且还杀死免疫抑制性细胞,例如髓源性抑制细胞(MDSC),后者是肿瘤中主要的免疫抑制因素,将其去除可促进抗肿瘤免疫应答。此外,免疫系统还会被肿瘤相关抗原和从死亡癌细胞释放的病毒蛋白进一步活化。这种方法选择性地杀死体内的癌细胞,同时保持健康的细胞不受伤害。
2. FDA 审批:迈向一线治疗肺癌,诺华Zykadia获FDA优先审评
诺华(Novartis)宣布,美国FDA接受了该公司的补充新药申请(sNDA),并批准优先审评扩大使用Zykadia(ceritinib)一线治疗转移性非小细胞肺癌(NSCLC)患者,这些病人的肿瘤通过FDA批准的测试所检测为间变性淋巴瘤激酶阳性(ALK+)。 FDA还向Zykadia授予了突破性疗法认定,用于一线治疗ALK+转移性NSCLC患者,癌细胞转移至了脑部。
在全世界范围内,肺癌导致的死亡人数比结肠癌、乳腺癌和前列腺癌加起来还要多,估计每年新增180万例肺癌病例。NSCLC最常见的肺癌类型,在这些患者中3-7%是ALK阳性的。Zykadia是一种间变性选择性间变性淋巴瘤激酶(ALK)抑制剂。众多医学研究表明, ALK可以与其他细胞功能蛋白结合以形成异常的“融合蛋白(fusion protein)”,造成癌症中某些肿瘤细胞的发展和生长,包括非小细胞肺癌(NSCLC)。Zykadia目前在全球64个国家获得批准。
使用Zykadia一线NSCLC的sNDA提交是基于对ASCEND-4研究的初步分析,ASCEND-4是一项全球3期随机、开放标签的多中心临床试验,评估了Zykadia与铂类化疗方案相比的安全性和有效性,还包括了在IIIB期或IV期ALK + NSCLC成人患者中的维持性治疗。该研究在28个国家的134个临床试验地点进行,随机分布于376例患者。研究发现:使用Zykadia一线治疗患者的中位无进展生存期(PFS)为16.6个月(95%置信区间[CI]:12.6,27.2),而标准一线培美曲塞铂化疗与培美曲塞维持治疗的患者为8.1个月(95%CI:5.8,11.1)。与化疗组相比,Zykadia组获得了45%的PFS风险降低(风险比[HR] = 0.55,[95%CI:0.42,0.73;单侧p值<0.001])。
3. 融资:靶向p53,PMV今日获7400万美元B轮融资
PMV Pharmaceuticals宣布完成了价值7400万美元的B轮融资,这家公司致力于发现和开发靶向p53的小分子药物治疗癌症。这轮融资由Topspin Biotech Fund和一批Euclidean Capital的投资者领投,其他参与者包括现有投资者InterWest Partners、OrbiMed Advisors和Osage University Partners。所募集的资金将用于开发和推进恢复突变型p53候选药物的临床管线。

p53是人类癌症中最常见的突变蛋白,一半以上的人类肿瘤含有突变型p53。该蛋白在机体对抗癌症的天然防御机制中起关键作用,并诱导高度组织的细胞死亡程序以防止潜在癌细胞的增殖。癌细胞的p53蛋白中往往带有突变,使癌细胞逃避死亡。PMV Pharma正在开发一流的p53和p53通路调节剂用于治疗癌症,PMV独特的作用机制有望使p53恢复其正常功能,消除这种逃避途径并选择性杀死突变型癌细胞而不影响正常组织。
PMV Pharma由Arnold Levine博士与其他科学家们共同创办,他是p53蛋白的发现者之一,目前任Institute for Advanced Study研究所Simons系统生物学中心的荣誉教授。PMV Pharma总部位于新泽西州的Cranbury,利用三十多年的p53生物学知识,将独特的生物学理解与药物开发重点结合。
4. 科研: Nature子刊:逆转癌细胞的基因重编程
肿瘤和胚胎之间存在相似之处,癌细胞和胚胎细胞都是快速分裂中的未完全分化细胞。当然,胚胎细胞的快速分化是正常的发育过程。而癌细胞则是组织细胞被不正常地“逆分化“到了更原始的状态,并进入了快速生长的状态。从快速分裂的未分化细胞到缓慢生长的分化细胞,细胞中的DNA序列并没有发生变化,而观遗传学起了很大的作用。表观遗传学研究的是那些对DNA进行修饰的蛋白,修饰的过程主要是对特定的碱基进行甲基化。表观遗传学中很重要的蛋白复合物是PRC2,在胚胎细胞中,PRC2非常活跃,它可以抑制数千个基因的表达,使细胞处于原始的未分化状态。而随着人的成长,PRC2逐渐进入了沉默状态,不再发挥作用。但是,研究发现,在包括B细胞淋巴瘤在内的某些肿瘤中,PRC2被重新激活,激活了的PRC2使癌细胞进入了快速分裂生长的状态。
最近,来自诺华(Novartis)中国生物医学研究中心的科学家们找到了一种方法,通过小分子药物结合PRC2复合物中的一个蛋白EED,可以有效地抑制PRC2的活性。这个方法小鼠的B细胞淋巴瘤模型中展示了良好的效果,这项研究被发表在了《自然》子刊《Nature Chemical Biology》上。诺华的团队没有试图直接抑制PRC2的活性位点,而是通过高通量筛选来寻找那些不直接结合PRC2的活性位点,但是能够抑制PRC2活性的小分子。在找到这样的一个分子之后,再通过化学生物学的方法来鉴定这个小分子在PRC2复合物上的结合部位,并对这个分子加以改进成为候选药物。
在研究过程中,诺华的团队发现,PRC2在对DNA进行修饰之前,需要先通过与一个DNA包装蛋白结合来确定修饰的位置。初步筛选出来的化合物中就有一个阻止了PRC2复合物中的EED蛋白与DNA包装蛋白的结合。进一步的结构生物学实验发现,这个化合物可以改变整个PRC2复合物的结构,从而使其失活。这个化合物在小鼠的B细胞淋巴瘤模型中恢复了数百个基因的正常表达,并使肿瘤出现萎缩。
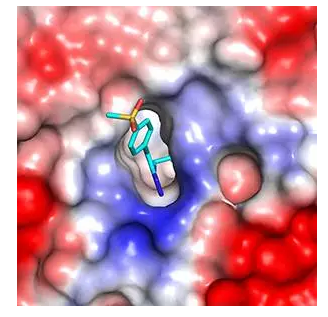
▲诺华研究团队筛选出能结合至EED的化合物(图片来源:《Nature Chemical Biology》)
这项研究的通讯作者、诺华中国生物医学中心主管李恩博士表示:“我们的这个化合物对癌细胞基因组进行了重编程,改变了许多基因的表达量,抑制了癌细胞生长。我们是为数不多的几个开发逆转癌细胞中不正常基因表达的药物的公司之一,这是治疗癌症的一种潜在的新方法。”基于这项研究,诺华的科学家们继续开发了一个优化后的候选药物MAK683,这个药物目前正在针对弥漫大B细胞淋巴瘤、鼻咽癌等多种癌症的1期临床试验中。我们希望这些试验顺利进行,早日为癌症患者带来新药。
5. 投资:复旦张江投200万美元于美国Adgero Biopharmaceutical
上海复旦张江生物医药股份有限公司注资200万美元于新泽西的 Adgero Biopharma 。 Adgero Biopharma 是一家专注于研发用以治疗癌症的光力学疗法( photodynamic therapy)。

该疗法利用光敏感化合物,引发局部癌症细胞的死亡。此类光敏感化合物当接触当特定频率的光线后,将引发细胞死亡程序。Adgero希望复旦张江公司能够帮助其获得此项技术在中国的专利权。
参考资料:
[1] Tocagen Receives Breakthrough Therapy Designation from U.S. Food and Drug Administration for Toca 511 & Toca FC in Recurrent High Grade Glioma
[2] Cancer startup PMV Pharma gains impressive $74M B round
[3] PMV Pharma Secures $74 Million in Series B Financing for Cancer Drugs Targeting p53
[4] Countering the genome reprogramming of cancer cell
[5] Fudan-Zhangjiang Bio-Pharma Invests $2 Million in Adgero of the US













请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)